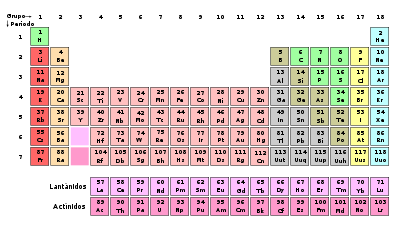
Se conoce como
tabla periódica de los elementos,
sistema periódico o simplemente como
tabla periódica, a un
esquema diseñado para organizar y segmentar cada elemento químico, de acuerdo a las propiedades y particularidades que posea.

Es una herramienta fundamental para el estudio de la
química pues permite conocer las semejanzas entre diferentes elementos y comprender qué puede resultar de las diferentes uniones entre los mismos.
Proceso de desarrollo del sistema periódico
Según se advierte al investigar sobre la tabla periódica, la historia de esta estructura está relacionada al descubrimiento de los diferentes elementos químicos y a la necesidad de ordenarlos de alguna manera.
A partir del siglo XIX los
científicos tuvieron la necesidad de establecer un orden en los elementos descubiertos. La forma en la que decidieron hacerlo, fue partiendo de sus
masas atómicas y agrupando aquellos que se asemejaran; sin embargo esta tarea no era tan sencilla ya que era difícil reflejar en un cuadro ordenado las similitudes y diferencias entre unos y otros.
El químico Döbereiner fue quien en 1817 presentó un informe donde se plasmaba la relación que existía entre la masa y las propiedades de los diferentes elementos. Así formó los grupos de elementos semejantes, como lo son las triadas, como la que forman cloro, bromo y yodo, donde la masa de uno de ellos se ubica en medio de los otros dos. Partiendo de esa investigación, en 1850, se llegaron a armar alrededor de 20 triadas.
Posteriormente,
Chancourtois y Newlands descubrieron la Ley de las octavas que permitió mejorar no sólo la distribución de los elementos en la tabla, sino las relaciones en ella plasmadas. Dicha Ley observa que las propiedades químicas se repiten sucesivamente cada ocho elementos. Sin embargo algunos elementos rompían con ella, por lo que no era suficiente para establecer una coherencia clara en la tabla.
Cuando en 1869 Meyer comprobó que el
volumen atómico de los elementos presentaba una cierta periodicidad; se supo que ciertos elementos que tenían un
volumen similar a aquellos elementos que se les parecen en composición.

Finalmente, en 1869 Mendeléyev presentó la
primera versión de la tabla periódica. La misma estaba compuesta por una columna con 63 elementos, agrupados de acuerdo a sus propiedades en común, y varios espacios en blanco. El químico ruso asumía que faltaban algunos no habían sido descubiertos, los correspondientes a las masas atómicas que aún no se conocían y que permitían que la tabla tuviera una regularidad numérica absoluta. Pese a que en su momento, su teoría no fue aceptada, pues parecía poco exacta, años más tarde al
descubrir los elementos faltantes, se comprobó que Mendeléyev tenía razón.
Más tarde, Mendeléyev añadió las fórmulas correspondientes a los óxidos e hidruros de cada sección. A finales del
siglo XIX, la tabla periódica comenzó a incluir el
grupo cero (con los denominados gases nobles), llamado de esa forma por la ausencia de actividad química (de valencia cero).
Es necesario reconocer, por último, la importancia de
John Dalton (
1766–
1844) en el desarrollo del concepto del atomismo químico, al suponer sobre las posibles combinaciones de los átomos de las sustancias. Dalton eligió a la masa de un átomo de hidrógeno como unidad referencial y creó una estructura basada en masas atómicas relativas.

 Posteriormente, Chancourtois y Newlands descubrieron la Ley de las octavas que permitió mejorar no sólo la distribución de los elementos en la tabla, sino las relaciones en ella plasmadas. Dicha Ley observa que las propiedades químicas se repiten sucesivamente cada ocho elementos. Sin embargo algunos elementos rompían con ella, por lo que no era suficiente para establecer una coherencia clara en la tabla.
Posteriormente, Chancourtois y Newlands descubrieron la Ley de las octavas que permitió mejorar no sólo la distribución de los elementos en la tabla, sino las relaciones en ella plasmadas. Dicha Ley observa que las propiedades químicas se repiten sucesivamente cada ocho elementos. Sin embargo algunos elementos rompían con ella, por lo que no era suficiente para establecer una coherencia clara en la tabla. Finalmente, en 1869 Mendeléyev presentó la primera versión de la tabla periódica. La misma estaba compuesta por una columna con 63 elementos, agrupados de acuerdo a sus propiedades en común, y varios espacios en blanco. El químico ruso asumía que faltaban algunos no habían sido descubiertos, los correspondientes a las masas atómicas que aún no se conocían y que permitían que la tabla tuviera una regularidad numérica absoluta. Pese a que en su momento, su teoría no fue aceptada, pues parecía poco exacta, años más tarde al descubrir los elementos faltantes, se comprobó que Mendeléyev tenía razón.
Finalmente, en 1869 Mendeléyev presentó la primera versión de la tabla periódica. La misma estaba compuesta por una columna con 63 elementos, agrupados de acuerdo a sus propiedades en común, y varios espacios en blanco. El químico ruso asumía que faltaban algunos no habían sido descubiertos, los correspondientes a las masas atómicas que aún no se conocían y que permitían que la tabla tuviera una regularidad numérica absoluta. Pese a que en su momento, su teoría no fue aceptada, pues parecía poco exacta, años más tarde al descubrir los elementos faltantes, se comprobó que Mendeléyev tenía razón.






0 comentarios:
Publicar un comentario